在目前的癌癥靶向藥物里,占主導(dǎo)地位的是針對(duì)致癌蛋白的小分子或單抗抑制劑。不過,隨著時(shí)間的推移,許多癌細(xì)胞會(huì)對(duì)這類藥物產(chǎn)生抗藥性,比如說產(chǎn)生新的突變,或者激活其它致癌蛋白。過去15年來,一些研究人員在尋找其它的抗癌途徑時(shí),將目標(biāo)瞄準(zhǔn)了細(xì)胞內(nèi)的“清潔工”——泛素-蛋白酶體系統(tǒng)。泛素-蛋白酶體系統(tǒng)負(fù)責(zé)清理細(xì)胞中無用或者有害的蛋白,通過激活這個(gè)系統(tǒng)特異性的清理致癌蛋白,有望恢復(fù)細(xì)胞內(nèi)的蛋白質(zhì)穩(wěn)態(tài),阻止癌癥的發(fā)生。近日,《科學(xué)》雜志刊登長(zhǎng)文,回顧并展望了以泛素-蛋白酶體為目標(biāo)的抗癌藥物研發(fā)。
抗癌藥物的新模式:誘導(dǎo)蛋白降解
許多癌癥靶向新藥都是針對(duì)致癌蛋白。這些小分子藥物通常都結(jié)合在那些致癌蛋白的活性位點(diǎn)以抑制其活性。對(duì)于這種模式的藥物來說,持續(xù)結(jié)合在蛋白的活性位點(diǎn)對(duì)于維持其療效是必需的。而這些致癌蛋白中有許多是活性部位結(jié)構(gòu)相似的激酶,使用高劑量的小分子藥物很有可能帶來非特異性的副作用。
▲作用于蛋白質(zhì)降解機(jī)制的抗癌藥物(圖片來源:《科學(xué)》)
誘導(dǎo)蛋白降解是最近興起的一種新的抗癌機(jī)制。理論上,只需要小分子藥物短暫地與致癌蛋白結(jié)合,給致癌蛋白打上“需要清理”的標(biāo)簽就可以了。這些藥物不需要很高的濃度,可以循環(huán)使用,并且蛋白被降解后需要重新合成才能恢復(fù)功能,這就極大地推遲了抗藥性的產(chǎn)生。
通過泛素-蛋白酶體系統(tǒng)降解蛋白分為幾步,先由E3連接酶給目標(biāo)蛋白加上一個(gè)泛素蛋白的標(biāo)簽,然后蛋白會(huì)經(jīng)過多輪泛素化后帶有多個(gè)泛素標(biāo)簽,多聚泛素化之后的蛋白會(huì)被26S蛋白酶體識(shí)別并被降解。
可以同時(shí)抑制蛋白活性和促進(jìn)蛋白降解的小分子藥物
研究顯示,一些被用作抑制致癌蛋白活性的小分子藥物同時(shí)能夠促進(jìn)目標(biāo)蛋白的降解。比如說canertinib是一個(gè)酪氨酸激酶ErbB-2的抑制劑,ErbB-2在多種癌癥內(nèi)有表達(dá),而canertinib可以增加ErbB-2的多聚泛素化以促進(jìn)其降解。ERα的抑制劑fulvestrant是另一個(gè)例子,它也可以促進(jìn)ERα的降解。在攜帶ERα的乳腺癌患者中,fulvestrant比另一個(gè)沒有促進(jìn)蛋白降解作用的ERα抑制劑tamoxifen的療效更好。對(duì)于急性早幼粒細(xì)胞白血病非常有效的藥物三氧化二砷,同樣可以促進(jìn)在該病患者中常見的融合致癌蛋白PML-RARα的降解。
▲Canertinib(左)、fulvestrant(中)和lenalidomide(右)分子結(jié)構(gòu)
(圖片來源:維基百科)
最近開發(fā)的用于多發(fā)性骨髓瘤的免疫療法藥物lenalidomide,也被發(fā)現(xiàn)可以誘導(dǎo)激酶CK1α和兩個(gè)在多發(fā)性骨髓瘤中非常重要的轉(zhuǎn)錄因子Ikaros和Aiolos的泛素化和降解。這些藥物的成功引起了整個(gè)行業(yè)對(duì)于促使蛋白降解的藥物的興趣。不過,人們?cè)谂既坏那闆r下,才發(fā)現(xiàn)這些藥物有增加蛋白降解的功能。如何針對(duì)蛋白降解系統(tǒng)有針對(duì)性地設(shè)計(jì)藥物仍然是一個(gè)挑戰(zhàn)。
蛋白裂解靶向嵌合體(PROTAC)技術(shù)
在自然情況下,E3泛素連接酶需要一個(gè)特殊的識(shí)別信號(hào)來招募并泛素化它的目標(biāo)蛋白。而PROTAC技術(shù)的出現(xiàn)使E3泛素化任何一個(gè)蛋白成為可能。這項(xiàng)技術(shù)設(shè)計(jì)一個(gè)雙重功能的分子,其一端可以結(jié)合目標(biāo)蛋白,另一端結(jié)合E3連接酶,并將兩者形成一個(gè)聚合物。此時(shí)E3就能夠泛素化目標(biāo)蛋白并引導(dǎo)其進(jìn)入降解通路。
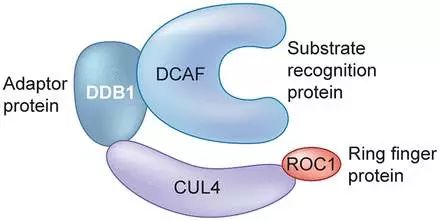
▲E3連接酶復(fù)合物(圖片來源:《Biochemical Journal》)
第一代的PROTAC分子成功地在體外實(shí)驗(yàn)中將在乳腺癌和前列腺癌中有重要作用的雌激素和雄激素受體泛素化并降解。不過,第一代PROTAC是一個(gè)多肽,由于其穿透細(xì)胞的效率很低,因此其效果不佳。后續(xù)的研究致力于開發(fā)真正的小分子PROTAC,這項(xiàng)努力通過一個(gè)E3連接酶的小分子配體nutlin得以實(shí)現(xiàn)。通過將nutlin與一個(gè)雄激素受體的小分子調(diào)節(jié)劑連接起來,成功地在宮頸癌細(xì)胞系HeLa中選擇性降解了雄激素受體。其它研究團(tuán)隊(duì)陸續(xù)合成了能夠選擇性降解致癌蛋白HIFα,ERRα和RIPK2等的PROTAC小分子。
PROTAC的未來發(fā)展
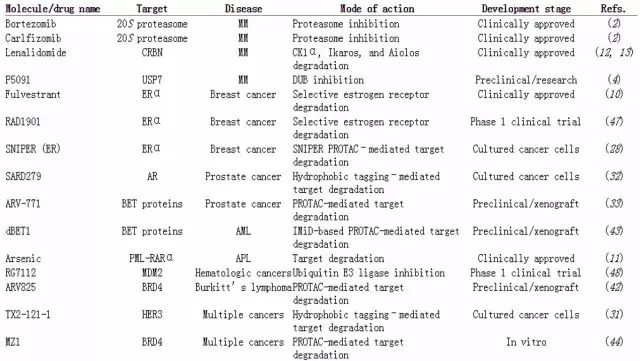
綜上所述,PROTAC分子有三個(gè)基本組成部分:一個(gè)目標(biāo)蛋白的配體、一個(gè)E3連接酶的配體和一個(gè)連接物。一個(gè)成功的PROTAC分子需要優(yōu)化所有三個(gè)組成部分。盡管人有超過700種不同的E3連接酶,其中幾種在癌細(xì)胞中主要的酶都已經(jīng)有了小分子配體,比如說CRBN的配體有thalidomide、lenalidomide和pomalidomide,cIAP1和MDM2的配體有methyl bestatin(MeBS)和nutlin。
除了目標(biāo)蛋白的配體和E3連接酶的配體之外,兩者之間的連接物也非常重要,其長(zhǎng)度、親疏水程度和剛性都對(duì)PROTAC的功能很重要。最近的一些研究顯示出了連接物中一個(gè)小變化也能對(duì)整個(gè)PROTAC的功能產(chǎn)生很大的影響。
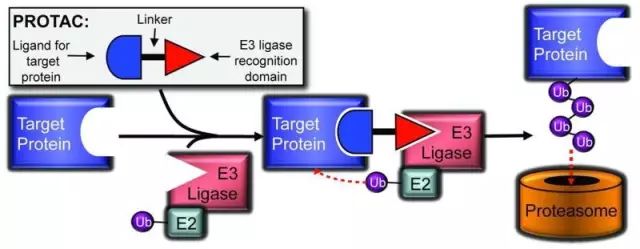
▲PROTAC技術(shù)基本模式(圖片來源:《ACS Chemical Biology》)
BCR-ABL是導(dǎo)致慢性髓細(xì)胞白血病的主要原因,它是一個(gè)融合后產(chǎn)生的致癌的酪氨酸激酶。盡管已經(jīng)有包括imatinib、bosutinib和dasatinib等小分子藥物可以抑制其活性,但部分患者會(huì)產(chǎn)生抗藥性。于是有科研人員基于這些藥物,試圖通過連接這些藥物和CRBN的配體pomalidomide或者另一個(gè)連接酶VHL的小分子配體,來制造PROTAC。他們測(cè)試了4個(gè)不同的連接物,其中一個(gè)因影響了與BCR-ABL的結(jié)合而失敗,基于imatinib的PROTAC成功地結(jié)合了BCR-ABL但是并不能誘導(dǎo)其降解。Dasatinib-CRBN和bosutinib-CRBN取得了最好的效果,成功地降解了BCR-ABL,但是bosutinib-VHL卻沒有能夠做到這一點(diǎn)。這些數(shù)據(jù)顯示,PROTAC三個(gè)組成部分中的任何一個(gè)部分出現(xiàn)變化都會(huì)改變整個(gè)分子的功能。
誘導(dǎo)蛋白降解的其它策略
除了PROTAC之外,還有一些具有潛力的策略可以開發(fā)促進(jìn)蛋白降解的小分子藥物。其中一種是PROTAC的類似物,這類被稱之為SNIPER PROTAC的小分子直接把目標(biāo)蛋白的配體和E3連接酶的配體融合在一起。其中一個(gè)例子是基于cIAP1配體MeBS和視黃酸受體配體全反式維甲酸(ATRA)的雜合物。它可以引導(dǎo)cIAP1泛素化和降解細(xì)胞內(nèi)的視黃酸結(jié)合蛋白,這些蛋白在急性早幼粒性白血病和神經(jīng)母細(xì)胞瘤中有重要作用。同樣使用SNIPER 技術(shù),通過tamoxifen靶向乳腺癌中的ERα也在體外實(shí)驗(yàn)中取得了不錯(cuò)的效果。
另外,基于蛋白質(zhì)上的疏水基團(tuán)來吸引泛素-蛋白酶體系統(tǒng)也是一種選擇。通常蛋白質(zhì)中的疏水部分都被包埋在蛋白內(nèi)部,只有當(dāng)?shù)鞍踪|(zhì)不正常折疊時(shí)疏水基團(tuán)在會(huì)被暴露出來。E3連接酶能夠自動(dòng)識(shí)別這些疏水基團(tuán)并降解這些不正常折疊的蛋白。由此,在一個(gè)目標(biāo)蛋白的小分子配體上加上一個(gè)疏水基團(tuán)就可以引來E3連接酶。已經(jīng)有科研團(tuán)隊(duì)將這個(gè)想法加以應(yīng)用,制造出了可以降解HER3和雄激素受體的小分子藥物。
▲各種PROTAC小分子及類似物(圖片來源:《Biochemical Journal》)
臨床前實(shí)驗(yàn)中的候選藥物
過去兩年里,特異和高效地降解關(guān)鍵致癌蛋白的努力取得了長(zhǎng)足的進(jìn)展。BET家族的蛋白,包括BRD4,在包括急性髓細(xì)胞白血病、多發(fā)性骨髓瘤、卵巢癌和前列腺癌在內(nèi)的多種癌癥的發(fā)展中其重要作用。多個(gè)BET的小分子抑制已經(jīng)進(jìn)入了臨床,但是,由于對(duì)于下游信號(hào)通路的抑制不夠充分,以及反饋機(jī)制能夠上調(diào)BRD4基因的表達(dá),這些藥物的有效性一般。
美國(guó)耶魯大學(xué)(Yale University)的一個(gè)團(tuán)隊(duì)設(shè)計(jì)了一個(gè)小分子PROTAC藥物ARV-825,它通過連接BRD4和CRBN,在細(xì)胞實(shí)驗(yàn)中可以完全降解BRD4蛋白。這個(gè)團(tuán)隊(duì)和一家生物科技公司Arvinas還開發(fā)了ARV-771,通過VHL來降解BET家族的蛋白。另一個(gè)來自美國(guó)丹娜法伯癌癥研究院(Dana-Farber Cancer Institute)的團(tuán)隊(duì)基于BET的小分子抑制劑JQ1設(shè)計(jì)了另一個(gè)小分子PROTAC藥物dBET1,這個(gè)藥物在小鼠的急性髓細(xì)胞白血病模型中展示了比JQ1更好的療效。
結(jié)語
靶向蛋白降解最有吸引力的地方在于它可以針對(duì)那些傳統(tǒng)上認(rèn)為不可成藥的蛋白靶點(diǎn),這些蛋白可能占了人類蛋白質(zhì)組的80%以上。由于靶向蛋白降解策略可以通過結(jié)合蛋白上的幾乎任何一個(gè)位點(diǎn),而不是活性位點(diǎn),來達(dá)到選擇性的降解蛋白的目的,因此理論上這個(gè)策略可以用于任何一個(gè)蛋白質(zhì)。此外,這個(gè)策略的另一個(gè)優(yōu)勢(shì)是可以對(duì)那些已經(jīng)產(chǎn)生抗藥性的腫瘤發(fā)揮作用。最后,靶向蛋白降解在除了癌癥以外的其它疾病中也具有相當(dāng)?shù)臐摿Α?/div>
我們祝愿這一全新的治療思路能早日帶來創(chuàng)新藥物,造福廣大癌癥患者。
參考資料
[1] Waste disposal—An attractive strategy for cancer therapy
[2] Stocking oncology's medicine cabinet